1. The Dry Cell Battery
Baterai (sel kering) adalah perangkat yang mengubah energi kimia menjadi energi listrik . Sel kering yang banyak digunakan dalam mainan, senter, radio portabel, kamera, alat bantu dengar, dan perangkat lainnya yang umum digunakan. Sebuah baterai terdiri dari sebuah luaran yang terbuat dari seng (negatif elektroda), batang karbon di tengah sel (elektroda positif), dan ruang antara mereka diisi dengan pasta elektrolit. Dalam operasi elektrolit, yang terdiri dari karbon tanah, mangan dioksida, sal amoniak, dan seng klorida, menyebabkan elektron mengalir dan menghasilkan listrik
Reaksi selnya adalah sebagai berikut :
Katoda (+) : 2 NH4+(aq) + 2 MnO2(s) + 2 e- ——> Mn2O3(s) + 2 NH3(aq) + H2O(l)
Anoda (-) : Zn(s) ——> Zn2+(aq) + 2 e-
Reaksi Sel : 2 NH4+(aq) + 2 MnO2(s) + Zn(s) ——> Mn2O3(s) + 2 NH3(aq) + H2O(l) + Zn2+(aq)
Katoda (+) : HgO(s) + H2O(l) + 2 e- ——> Hg(l) + 2 OH-(aq)
Anoda (-) : Zn(Hg) + 2 OH-(aq) ——> ZnO(s) + H2O(l) + 2 e‑
Reaksi sel : Zn(Hg) + HgO(s) ——> ZnO(s) + Hg(l)
3. The Lead Storage Battery
Aki/accu. Baterai penyimpan plumbum (timbal) terdiri dari enam sel yang terhubung secara seri. Anoda pada setiap sel adalah plumbum (Pb), sedangkan katodanya adalah plumbum dioksida (PbO2). Elektroda dicelupkan ke dalam larutan asam sulfat (H2SO4).
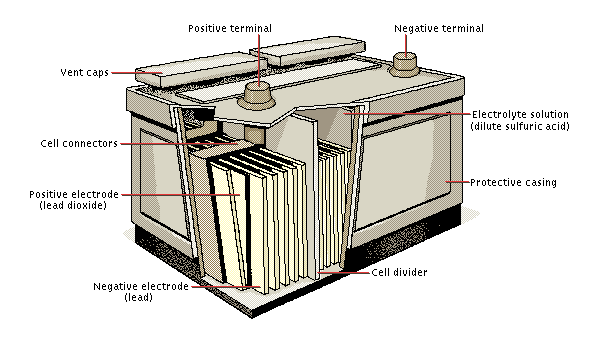
Reaksi selnya pada saat pemakaian aki adalah sebagai berikut :
Katoda (+) : PbO2(s) + 4 H+(aq) + SO42-(aq) + 2 e- ——> PbSO4(s) + 2 H2O(l)
Anoda (-) : Pb(s) + SO42-(aq) ——> PbSO4(s) + 2 e-
Reaksi sel : PbO2(s) + Pb(s) + 4 H+(aq) + 2 SO42-(aq) ——> 2 PbSO4(s) + 2 H2O(l)
Pada kondisi normal, masing-masing sel menghasilkan potensial sebesar 2 volt. Dengan demikian, sebuah aki dapat menghasilkan potensial sebesar 12 volt. Ketika reaksi diatas terjadi, kedua elektroda menjadi terlapisi oleh padatan plumbum (II) sulfat, PbSO4, dan asam sulfatnya semakin habis. Semua sel galvani menghasilkan listrik sampai semua reaktannya habis, kemudian harus dibuang. Hal ini terjadi pada sel kering dan sel merkuri. Namun, sel aki dapat diisi ulang (rechargeable), sebab reaksi redoksnya dapat dibalik untuk menghasilkan reaktan awalnya. Reaksi yang terjadi saat pengisian aki merupakan kebalikan dari reaksi yang terjadi saat pemakaian aki.
4. The Lithium-Ion Battery
 Baterai ini memiliki massa yang ringan sehingga bersifat portable. Potensial yang dihasilkan cukup besar, yaitu sekitar 3,4 volt. Anodanya adalah Li dalam grafit, sementara katodanya adalah oksida logam transisi (seperti CoO2). Elektrolit yang digunakan adalah pelarut organik dan sejumlah garam organik.
Baterai ini memiliki massa yang ringan sehingga bersifat portable. Potensial yang dihasilkan cukup besar, yaitu sekitar 3,4 volt. Anodanya adalah Li dalam grafit, sementara katodanya adalah oksida logam transisi (seperti CoO2). Elektrolit yang digunakan adalah pelarut organik dan sejumlah garam organik.
Reaksi yang terjadi adalah sebagai berikut :
Katoda (+) : Li+(aq) + CoO2(s) + e- ——> LiCoO2(s)
Anoda (-) : Li(s) ——> Li+ (aq) + e-
Reaksi sel : Li(s) + CoO2(s) ——> LiCoO2(s)
5. Fuel Cell
 Dikenal pula dengan istilah sel bahan bakar. Sebuah sel bahan bakar hidrogen-oksigen yang
sederhana tersusun atas dua elektroda inert dan larutan elektrolit,
seperti kalium hidroksida. Gelembung gas hidrogen dan oksigen dialirkan
pada masing-masing elektroda. Potensial yang dihasilkan adalah sebesar
1,23 volt.
Dikenal pula dengan istilah sel bahan bakar. Sebuah sel bahan bakar hidrogen-oksigen yang
sederhana tersusun atas dua elektroda inert dan larutan elektrolit,
seperti kalium hidroksida. Gelembung gas hidrogen dan oksigen dialirkan
pada masing-masing elektroda. Potensial yang dihasilkan adalah sebesar
1,23 volt.
Reaksi yang terjadi adalah sebagai berikut :
Katoda (+) : O2(g) + 2 H2O(l) +4 e- ——> 4 OH-(aq) Anoda (-) : 2 H2(g) + 4 OH-(aq) ——> 4 H2O(l) + 4 e-
Reaksi sel : O2(g) + 2 H2(g) ——> 2 H2O(l)
Katoda (+) : 2 NH4+(aq) + 2 MnO2(s) + 2 e- ——> Mn2O3(s) + 2 NH3(aq) + H2O(l)
Anoda (-) : Zn(s) ——> Zn2+(aq) + 2 e-
Reaksi Sel : 2 NH4+(aq) + 2 MnO2(s) + Zn(s) ——> Mn2O3(s) + 2 NH3(aq) + H2O(l) + Zn2+(aq)
Dalam baterai ini, anodanya adalah logam seng (membentuk amalgama dengan merkuri), sementara katodanya adalah baja (stainless steel cylinder). Elektrolit yang digunakan dalam baterai ini adalah merkuri (II) Oksida, HgO. Potensial yang dihasilkan sebesar 1,35 volt.
Reaksi selnya adalah sebagai berikut :Katoda (+) : HgO(s) + H2O(l) + 2 e- ——> Hg(l) + 2 OH-(aq)
Anoda (-) : Zn(Hg) + 2 OH-(aq) ——> ZnO(s) + H2O(l) + 2 e‑
Reaksi sel : Zn(Hg) + HgO(s) ——> ZnO(s) + Hg(l)
3. The Lead Storage Battery
Aki/accu. Baterai penyimpan plumbum (timbal) terdiri dari enam sel yang terhubung secara seri. Anoda pada setiap sel adalah plumbum (Pb), sedangkan katodanya adalah plumbum dioksida (PbO2). Elektroda dicelupkan ke dalam larutan asam sulfat (H2SO4).

Reaksi selnya pada saat pemakaian aki adalah sebagai berikut :
Katoda (+) : PbO2(s) + 4 H+(aq) + SO42-(aq) + 2 e- ——> PbSO4(s) + 2 H2O(l)
Anoda (-) : Pb(s) + SO42-(aq) ——> PbSO4(s) + 2 e-
Reaksi sel : PbO2(s) + Pb(s) + 4 H+(aq) + 2 SO42-(aq) ——> 2 PbSO4(s) + 2 H2O(l)
Pada kondisi normal, masing-masing sel menghasilkan potensial sebesar 2 volt. Dengan demikian, sebuah aki dapat menghasilkan potensial sebesar 12 volt. Ketika reaksi diatas terjadi, kedua elektroda menjadi terlapisi oleh padatan plumbum (II) sulfat, PbSO4, dan asam sulfatnya semakin habis. Semua sel galvani menghasilkan listrik sampai semua reaktannya habis, kemudian harus dibuang. Hal ini terjadi pada sel kering dan sel merkuri. Namun, sel aki dapat diisi ulang (rechargeable), sebab reaksi redoksnya dapat dibalik untuk menghasilkan reaktan awalnya. Reaksi yang terjadi saat pengisian aki merupakan kebalikan dari reaksi yang terjadi saat pemakaian aki.
4. The Lithium-Ion Battery
 Baterai ini memiliki massa yang ringan sehingga bersifat portable. Potensial yang dihasilkan cukup besar, yaitu sekitar 3,4 volt. Anodanya adalah Li dalam grafit, sementara katodanya adalah oksida logam transisi (seperti CoO2). Elektrolit yang digunakan adalah pelarut organik dan sejumlah garam organik.
Baterai ini memiliki massa yang ringan sehingga bersifat portable. Potensial yang dihasilkan cukup besar, yaitu sekitar 3,4 volt. Anodanya adalah Li dalam grafit, sementara katodanya adalah oksida logam transisi (seperti CoO2). Elektrolit yang digunakan adalah pelarut organik dan sejumlah garam organik.
Reaksi yang terjadi adalah sebagai berikut :
Katoda (+) : Li+(aq) + CoO2(s) + e- ——> LiCoO2(s)
Anoda (-) : Li(s) ——> Li+ (aq) + e-
Reaksi sel : Li(s) + CoO2(s) ——> LiCoO2(s)
5. Fuel Cell
 Dikenal pula dengan istilah sel bahan bakar. Sebuah sel bahan bakar hidrogen-oksigen yang
sederhana tersusun atas dua elektroda inert dan larutan elektrolit,
seperti kalium hidroksida. Gelembung gas hidrogen dan oksigen dialirkan
pada masing-masing elektroda. Potensial yang dihasilkan adalah sebesar
1,23 volt.
Dikenal pula dengan istilah sel bahan bakar. Sebuah sel bahan bakar hidrogen-oksigen yang
sederhana tersusun atas dua elektroda inert dan larutan elektrolit,
seperti kalium hidroksida. Gelembung gas hidrogen dan oksigen dialirkan
pada masing-masing elektroda. Potensial yang dihasilkan adalah sebesar
1,23 volt.Reaksi yang terjadi adalah sebagai berikut :
Katoda (+) : O2(g) + 2 H2O(l) +4 e- ——> 4 OH-(aq) Anoda (-) : 2 H2(g) + 4 OH-(aq) ——> 4 H2O(l) + 4 e-
Reaksi sel : O2(g) + 2 H2(g) ——> 2 H2O(l)











0 comments:
Post a Comment