Elektroplating memiliki, selama beberapa dekade terakhir, berevolusi dari seni untuk ilmu pasti. Perkembangan
ini dipandang sebagai bertanggung jawab atas jumlah yang terus
meningkat dan memperluas jenis aplikasi dari cabang ilmu pengetahuan
praktis dan teknik. Beberapa
bidang teknologi di mana cara dan metode elektroplating merupakan
komponen penting semua aspek elektronik: makro dan mikro, optik,
opto-elektronik, dan sensor dari sebagian besar jenis, untuk nama hanya
beberapa. Selain itu sejumlah industri utama seperti industri otomotif (yang menggunakan misalnya chrome plating
untuk meningkatkan korosi resistensi bagian logam) mengadopsi metode bahkan di mana metode lain, seperti penguapan, sputtering, deposisi uap kimia (CVD) dan seperti adalah pilihan. Itu untuk alasan ekonomi dan kenyamanan. Dengan cara ilustrasi perlu dicatat bahwa elektroplating modern yang melengkapi praktisi dengan kemampuan untuk Pra Desain sifat permukaan dan dalam hal electroforming orang-orang dari seluruh bagian. Selain itu, kemampuan untuk deposit multilayers sangat tipis (kurang dari sepersejuta cm ) melalui elektroplating merupakan satu lagi jalan baru untuk memproduksi material baru.
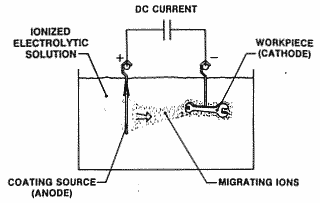
Elektroplating sering juga disebut "elektrodeposisi", dan kedua istilah ini digunakan secara bergantian. Sebagai soal fakta, "electroplating" dapat dianggap terjadi oleh proses elektrodeposisi . Elektrodeposisi adalah proses memproduksi lapisan, biasanya logam, pada permukaan oleh aksi arus listrik . Pengendapan lapisan logam ke sebuah objek dicapai dengan menempatkan negatif muatan pada objek yang akan dilapisi dan merendam ke dalam larutan yang mengandung garam dari logam yang akan disimpan (dengan kata lain, obyek yang akan dibuat berlapis pada katoda dari sel elektrolit ). Metalik ion garam membawa muatan positif dan dengan demikian tertarik pada objek. Ketika mereka mencapai obyek bermuatan negatif (yang akan dilapisi), ia menyediakan elektron untuk mengurangi ion bermuatan positif untuk bentuk logam. Gambar 1 adalah presentasi skematik dari sel elektrolit untuk menyepuh logam "M" dari air (air) larutan garam logam "MA".
Nikel klorida digunakan di sini untuk contoh proses elektroplating untuk sejumlah alasan. Pertama di antara mereka adalah kesederhanaan. Hal ini tidak dianjurkan, namun, nikel yang digunakan untuk, katakanlah, demonstrasi sains sekolah karena beberapa individu yang cukup alergi. Kami lebih tidak menyarankan bahwa garam klorida digunakan karena mereka setuju untuk melepaskan gas klorin. Untuk sekolah atau amatir jenis demonstrasi kami sarankan plating koin tembaga dengan seng atau nikel koin dengan tembaga.
 M + n + ne - ==> M
M + n + ne - ==> M
untuk meningkatkan korosi resistensi bagian logam) mengadopsi metode bahkan di mana metode lain, seperti penguapan, sputtering, deposisi uap kimia (CVD) dan seperti adalah pilihan. Itu untuk alasan ekonomi dan kenyamanan. Dengan cara ilustrasi perlu dicatat bahwa elektroplating modern yang melengkapi praktisi dengan kemampuan untuk Pra Desain sifat permukaan dan dalam hal electroforming orang-orang dari seluruh bagian. Selain itu, kemampuan untuk deposit multilayers sangat tipis (kurang dari sepersejuta cm ) melalui elektroplating merupakan satu lagi jalan baru untuk memproduksi material baru.
Elektroplating sering juga disebut "elektrodeposisi", dan kedua istilah ini digunakan secara bergantian. Sebagai soal fakta, "electroplating" dapat dianggap terjadi oleh proses elektrodeposisi . Elektrodeposisi adalah proses memproduksi lapisan, biasanya logam, pada permukaan oleh aksi arus listrik . Pengendapan lapisan logam ke sebuah objek dicapai dengan menempatkan negatif muatan pada objek yang akan dilapisi dan merendam ke dalam larutan yang mengandung garam dari logam yang akan disimpan (dengan kata lain, obyek yang akan dibuat berlapis pada katoda dari sel elektrolit ). Metalik ion garam membawa muatan positif dan dengan demikian tertarik pada objek. Ketika mereka mencapai obyek bermuatan negatif (yang akan dilapisi), ia menyediakan elektron untuk mengurangi ion bermuatan positif untuk bentuk logam. Gambar 1 adalah presentasi skematik dari sel elektrolit untuk menyepuh logam "M" dari air (air) larutan garam logam "MA".
Nikel klorida digunakan di sini untuk contoh proses elektroplating untuk sejumlah alasan. Pertama di antara mereka adalah kesederhanaan. Hal ini tidak dianjurkan, namun, nikel yang digunakan untuk, katakanlah, demonstrasi sains sekolah karena beberapa individu yang cukup alergi. Kami lebih tidak menyarankan bahwa garam klorida digunakan karena mereka setuju untuk melepaskan gas klorin. Untuk sekolah atau amatir jenis demonstrasi kami sarankan plating koin tembaga dengan seng atau nikel koin dengan tembaga.
Persiapan permukaan
Hal ini umumnya diterima dan sering dikutip electroplaters bahwa seseorang
dapat membuat lapisan miskin tampil dengan pretreatment baik, tapi kita
tidak bisa membuat lapisan yang sangat baik tampil dengan pretreatment miskin. Permukaan
pretreatment dengan kimia dan / atau mekanis berarti penting tidak
hanya dalam hal persiapan untuk menyepuh tetapi juga diperlukan dalam
persiapan untuk lukisan. Dalam salah satu dari ini, metode yang dirancang untuk memastikan adhesi yang baik dari lapisan atau cat ke permukaan. Sebagian besar (logam) pengobatan dan pelapisan permukaan operasi memiliki tiga langkah dasar.
Pembersihan permukaan atau persiapan. Biasanya ini termasuk mempekerjakan pelarut, alkali pembersih, asam pembersih, bahan abrasif dan / atau air.
Modifikasi permukaan. Itu termasuk perubahan atribut permukaan, seperti aplikasi (logam) lapisan (s) dan / atau pengerasan.
Membilas atau pekerjaan lain-piece menyelesaikan operasi untuk menghasilkan / mendapatkan produk akhir.
Elektrodeposisi atau deposisi elektrokimia (logam atau paduan) melibatkan reduksi logam ion dari air , organik, atau menyatu garam elektrolit . Dalam bentuk yang paling sederhana reaksi dalam medium berair di katoda mengikuti persamaan.
dengan sesuai anodik reaksi. Material anoda dapat menjadi logam untuk disimpan (dalam hal ini reaksi elektroda adalah electrodissolution yang terus memasok ion logam) atau anoda bisa menjadi lembam material dan reaksi anodik adalah evolusi oksigen (dalam hal ini solusi plating akhirnya habis ion logam).
Deposisi dapat, pada prinsipnya, dapat dicapai melalui dua jalur yang berbeda:
Sebuah proses elektrodeposisi di mana elektron yang disediakan oleh eksternal power supply .
Sebuah electroless (autocatalytic) proses pengendapan di mana agen pereduksi dalam larutan adalah sumber elektron.









0 comments:
Post a Comment